【广东】关于试行医疗器械注册用电子检验报告工作的通知
各相关单位:
为了配合广东省药品监督管理局贯彻落实《医疗器械监督管理条例》有关信息化建设要求,优化注册检验流程,实现企业领取检验报告、提交注册申请“零跑动”,现就开展医疗器械注册用电子检验报告试行工作通知如下:
一、为支持省局智慧药监系统建设,我所出具的医疗器械注册用检验报告,已通过接口方式同步到省局智慧药监系统。注册申请人在线申报第二类医疗器械注册相关业务时,可凭检验报告编号自动获取检验报告电子版进行提交。
二、企业向我所申请医疗器械产品检验时,应明确是否用于注册申报。对以注册申报为目的检验业务,注册检验费用按照《关于确保免征部分涉企行政事业性收费省级收入政策贯彻落实的通知》(粤发改发电[2014]34号)、《关于免征中央 省设立的涉企行政事业性收费省级收入的通知》(粤财综[2014]89号)和《关于清理规范一批行政事业性收费有关政策的通知》(财税[2017]20号)文件要求实行免征。我所在完成检验后,出具电子检验报告直接推送至省局智慧药监系统,并以短信和邮件方式通知企业检验报告编号。企业如需纸质版报告,可凭省局注册缴费凭证向我所申领。
三、企业在我所申请第二类医疗器械注册检验时,送检样品应是出厂检验合格产品,符合医疗器械安全性和有效性,其生产应当符合医疗器械生产质量管理规范的相关要求。
在注册申报过程中使用电子检验报告时,如有疑问,可咨询业务科电话:020-66602388(工作日:9:00-17:00)、18926290812(工作日:8:30-20:30)。
本通知自2022年1月1日签订试验合同起实施。
特此通知。
附件:智慧药监系统上传无纸化报告操作指引.docx
广东省医疗器械质量监督检验所
2021年12月27日
附件:
智慧药监系统上传无纸化报告操作指引
1 目的
为确保智慧药监系统用户快速上传注册检验报告,特制定本指引。
2 范围
本指引仅适用于医疗器械产品在广东省医疗器械质量监督检验所(以下简称“省医械所”)开展注册检验的电子检验报告。
3 步骤
企业登录智慧食药监系统,在“省局行政审批业务-业务申报”环节选择“第二类医疗器械注册证核发”。具体操作步骤如下:
第一步:按要求正确填写“受理信息”页面内容,带*字段为必填项。核实信息无误后,点击【下一步】按钮,跳往“申请信息”页面
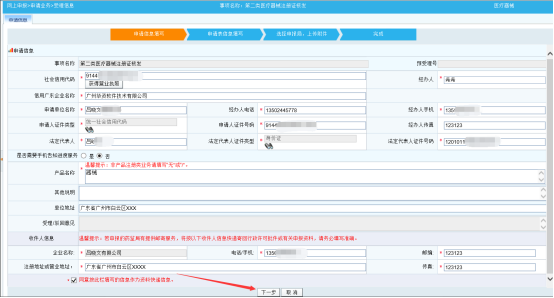
第二步:填写申请信息内容,核实所需信息都填写无误后,点击【保存】按钮。
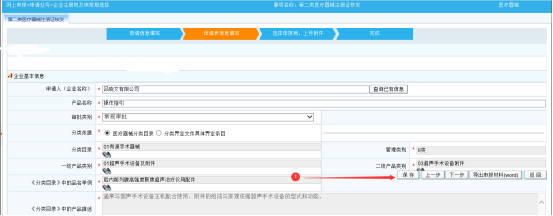
第三步:点击下一步,进入材料申请页面。正确选择申报局、申报类别等信息,以及上传各材料,如下图:

针对医疗器械检验报告材料,可选择手动上传或自动获取。
①手动上传:点击上图【手动上传医疗器械检验报告】按钮,打开上传附件页弹窗,可【浏览】本地文件选中后完成【上传】。
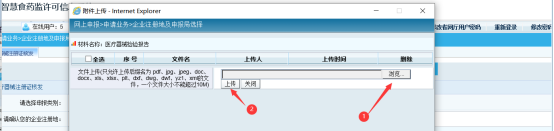
②自动获取:点击上图【自动获取医疗器械检验报告】按钮,进入“医疗器械检验报告”信息页。点击“查询并获取”按钮,打开“查询检验报告页”弹窗。
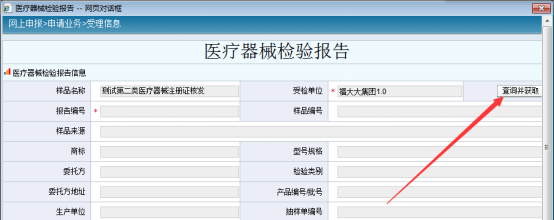
可在“报告编号”栏准确输入省医械所送检产品注册检验报告编号,点击“查询”按钮;可根据查询出的报告自行勾选所需上传报告。在注册检验报告查询过程中,系统不支持模糊查询,报告编号需要输入完整编号,注意存在大小写区别。系统不支持在线查询检验报告内容。
4 异常情况处理
输入报告编号后系统未显示相关报告信息,需核实报告编号信息是否输入正确,确保输入信息与收到省医械所推送短信或邮箱信息是否一致。核对后仍未能找到相关报告,请致电020-66602388(工作日:9:00-17:00)、18926290812(工作日:8:30-20:30)省医械所业务科进行查询核实,也可在申请材料页面手动上传检验报告。
【来源】广东省医疗器械质量监督检验所
【声明】部分文章和信息来源于互联网,不代表本订阅号赞同其观点和对其真实性负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施。